29. decembra agrās stundās NEJM tiešsaistē publicēja jaunu klīniskās fāzes III fāzes pētījumu par jauno Ķīnas koronavīrusu VV116.Rezultāti parādīja, ka VV116 nebija sliktāks par Paxlovid (nematovīrs/ritonavīrs) klīniskās atveseļošanās ilguma ziņā un tam bija mazāk blakusparādību.
Attēla avots: NEJM
Vidējais atveseļošanās laiks 4 dienas, blakusparādību biežums 67,4%
VV116 ir perorāla nukleozīdu pretjaunā koronavīrusa (SARS-CoV-2) zāles, kas izstrādātas sadarbībā ar Junsit un Wang Shan Wang Shui, un tās ir RdRp inhibitors kopā ar Gilead remdesiviru, Merck Sharp & Dohme molnupiraviru un Real Biologics azelvudīnu.
2021. gadā Uzbekistānā tika pabeigts VV116 II fāzes klīniskais pētījums.Pētījuma rezultāti parādīja, ka VV116 grupa varētu labāk uzlabot klīniskos simptomus un ievērojami samazināt progresēšanas risku līdz kritiskajai formai un nāves risku, salīdzinot ar kontroles grupu.Pamatojoties uz šī izmēģinājuma pozitīvajiem rezultātiem, VV116 ir apstiprināts Uzbekistānā pacientu ar vidēji smagu līdz smagu COVID-19 ārstēšanai un ir kļuvis par pirmo jauno perorālo koronāro medikamentu, kas apstiprināts tirdzniecībai ārzemēs Ķīnā [1].
Šis III fāzes klīniskais pētījums[2] (NCT05341609), ko vadīja prof. Džao Rens no Šanhajas Rujjinas slimnīcas, Šanhajas Rendži slimnīcas prof. Gaojuans un Šanhajas Ruijinas slimnīcas akadēmiķis Nings Guangs, tika pabeigts Omikrona varianta izraisītā uzliesmojuma laikā ( B.1.1.529) no marta līdz maijam Šanhajā, lai novērtētu VV116 efektivitāti un drošību salīdzinājumā ar Paxlovid vieglas vai vidēji smagas COVID-19 pacientu agrīnai ārstēšanai.Mērķis bija novērtēt VV116 efektivitāti un drošību salīdzinājumā ar Paxlovid, lai agrīni ārstētu pacientus ar vieglu vai vidēji smagu COVID-19.
Attēla avots: 2. atsauce
No 2022. gada 4. aprīļa līdz 2. maijam tika veikts daudzcentru, novērotāju akls, randomizēts, kontrolēts pētījums, kurā piedalījās 822 pieauguši Covid-19 pacienti ar augstu progresēšanas risku un viegliem vai vidēji smagiem simptomiem, lai novērtētu dalībnieku atbilstību septiņām Šanhajas slimnīcām. Ķīna.Galu galā 771 dalībnieks saņēma vai nu VV116 (384, 600 mg ik pēc 12 stundām 1. dienā un 300 mg ik pēc 12 stundām 2.–5. dienā) vai Paxovid (387, 300 mg nimatuvīra + 100 mg ritonavīra ik pēc 12 stundām 5 dienas). perorālās zāles.
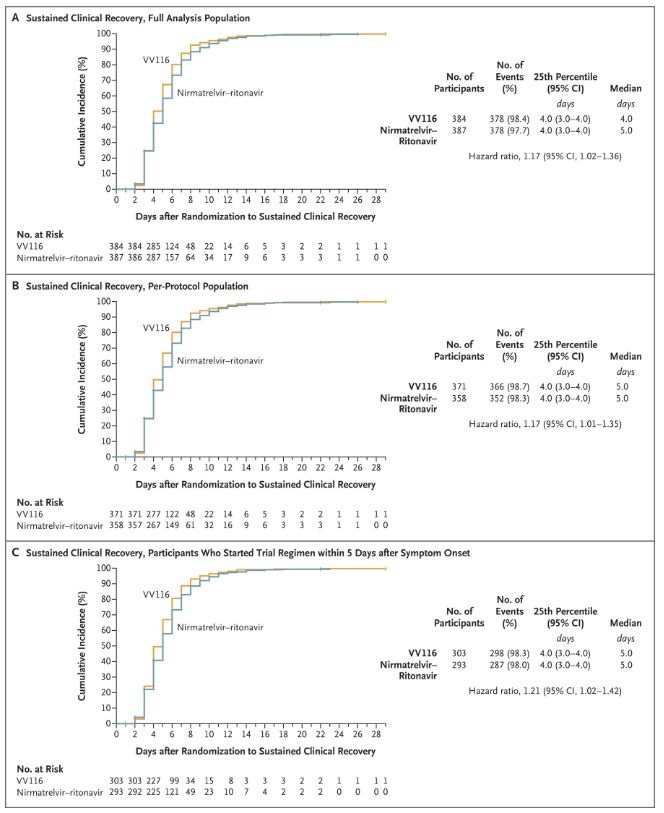
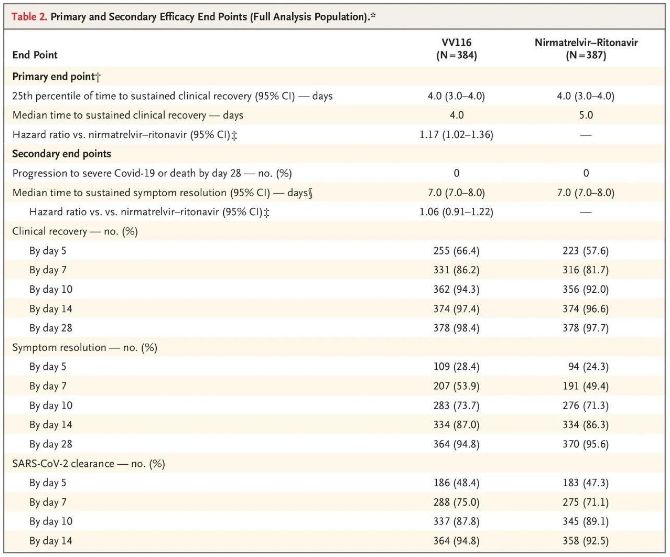
Šī klīniskā pētījuma rezultāti parādīja, ka viegla vai vidēji smaga COVID-19 agrīna ārstēšana ar VV116 atbilda primārajam mērķa kritērijam (laiks līdz ilgstošai klīniskai atveseļošanai), kas prognozēts klīniskajā protokolā: vidējais laiks līdz klīniskai atveseļošanai bija 4 dienas VV116 grupā un 5 dienas. dienas Paxlovid grupā (riska attiecība, 1,17; 95% TI, 1,02 līdz 1,36; apakšējā robeža. >0,8).
Klīniskās atveseļošanās laika saglabāšana
Primārie un sekundārie efektivitātes galapunkti (visaptveroša populācijas analīze)
Attēla avots: 2. atsauce
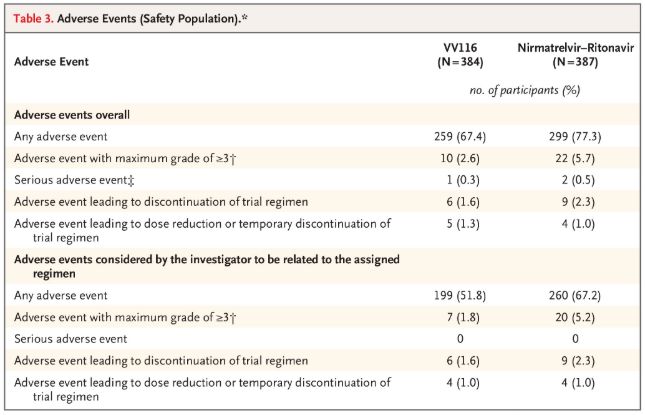
Runājot par drošību, dalībnieki, kuri saņēma VV116, ziņoja par mazāku blakusparādību skaitu (67,4%) nekā tie, kuri saņēma Paxlovid (77,3%) 28 dienu novērošanas laikā, un 3./4. pakāpes blakusparādību biežums bija mazāks VV116 (2,6%). ) nekā Paxlovid (5,7%).
Nevēlami notikumi (droši cilvēki)
Attēla avots: 2. atsauce
Strīdi un jautājumi
2022. gada 23. maijā Juniper atklāja, ka III fāzes reģistrācijas klīniskais pētījums par VV116 un PAXLOVID vieglas vai vidēji smagas Covid-19 (NCT05341609) agrīnai ārstēšanai atbilst primārajam pētījuma mērķa kritērijam.
Attēla avots: 1. atsauce
Laikā, kad trūka sīkākas informācijas par izmēģinājumu, pretrunas par III fāzes pētījumu bija divējādas: pirmkārt, tas bija vienmaskēts pētījums, un, ja nebija placebo kontroles, bija bažas, ka to būs grūti spriest. zāles pilnīgi objektīvi;otrkārt, bija jautājumi par klīniskajiem parametriem.
Juniper klīniskie iekļaušanas kritēriji ir (i) pozitīvi rezultāti jaunajam vainaga testam, (ii) viens vai vairāki viegli vai vidēji smagi COVID-19 simptomi un (iii) pacienti ar augstu smagas COVID-19, tostarp nāves, risku.Tomēr vienīgais primārais klīniskais mērķa kritērijs ir “laiks līdz ilgstošai klīniskai atveseļošanai”.
Tieši pirms paziņojuma, 14. maijā, Juniper bija pārskatījis klīniskos parametrus, noņemot vienu no klīniskajiem primārajiem mērķa kritērijiem, "nopietnas slimības vai nāves pārvēršanas proporcija" [3].
Attēla avots: 1. atsauce
Šie divi galvenie strīdu punkti arī tika īpaši aplūkoti publicētajā pētījumā.
Pēkšņa Omicron uzliesmojuma dēļ Paxlovid paredzēto placebo tablešu ražošana nebija pabeigta pirms izmēģinājuma sākuma, un tāpēc pētnieki nevarēja veikt šo izmēģinājumu, izmantojot dubultmaskētu, dubultā izspēles dizainu.Attiecībā uz klīniskā izmēģinājuma vieni aklo aspektu Džunipers sacīja, ka protokols tika veikts pēc saziņas ar regulatīvajām iestādēm un ka vienmaskums nozīmē, ka ne pētnieks (tostarp pētījuma beigu punkta vērtētājs), ne sponsors to nezinās. konkrēto terapeitisko zāļu piešķiršanu, līdz pētījuma beigās tiek bloķēta galīgā datubāze.
Līdz galīgās analīzes brīdim neviens no izmēģinājuma dalībniekiem nebija piedzīvojis nāvi vai progresēšanu līdz smagam Covid-19 notikumam, tāpēc nevar izdarīt secinājumus par VV116 efektivitāti, novēršot progresēšanu līdz smagai vai kritiskai Covid-19. vai nāve.Dati liecināja, ka aptuvenais vidējais laiks no randomizācijas līdz ar Covid-19 saistīto mērķa simptomu ilgstošai regresijai bija 7 dienas (95% TI, 7 līdz 8) abās grupās (riska attiecība, 1,06; 95% TI, 0,91 līdz 1,22). [2].Nav grūti izskaidrot, kādēļ tika noņemts primārais mērķa kritērijs “pārvēršanās biežums smagai slimībai vai nāvei”, kas sākotnēji tika noteikts pirms izmēģinājuma beigām.
2022. gada 18. maijā žurnālā Emerging Microbes & Infections tika publicēti VV116 pirmā klīniskā pētījuma rezultāti ar pacientiem, kas inficēti ar Omicron variantu [4]. Tas ir atklāts, perspektīvs kohortas pētījums ar 136 apstiprinātiem stacionāriem.
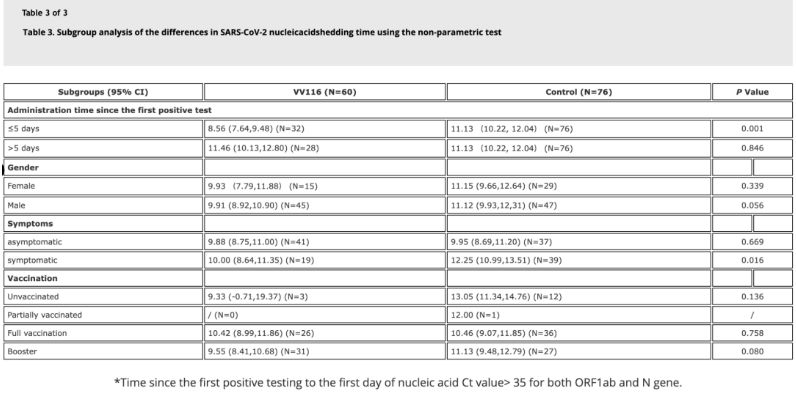
Pētījuma dati parādīja, ka pacientiem ar Omicron infekciju, kuri lietoja VV116 5 dienu laikā pēc pirmā pozitīvā nukleīnskābju testa, laiks līdz nukleīnskābju regresijai bija 8,56 dienas, kas ir mazāk nekā 11,13 dienas kontroles grupā.VV116 ievadīšana simptomātiskiem pacientiem šī pētījuma laikā (2–10 dienas pēc pirmā pozitīvā nukleīnskābes testa) samazināja laiku līdz nukleīnskābju regresijai visiem pacientiem.Runājot par zāļu drošumu, VV116 terapijas grupā netika novērotas nopietnas blakusparādības.
Attēla avots: 4. atsauce
Pašlaik notiek trīs VV116 klīniskie pētījumi, no kuriem divi ir III fāzes pētījumi par vieglu vai vidēji smagu COVID-19 (NCT05242042, NCT05582629).Otrs pētījums par vidēji smagu vai smagu COVID-19 ir starptautisks daudzcentru, randomizēts, dubultmaskēts III fāzes klīniskais pētījums (NCT05279235), lai novērtētu VV116 efektivitāti un drošību salīdzinājumā ar standarta ārstēšanu.Saskaņā ar Junipera paziņojumu pirmais pacients tika reģistrēts un viņam tika dota 2022. gada martā.
Attēla avots: clinicaltrials.gov
Atsauces:
[1]Junshi Biotech: paziņojums par VV116 un PAXLOVID reģistrētā III fāzes klīniskā pētījuma galveno beigu punktu vieglas vai vidēji smagas Covid-19 agrīnai ārstēšanai
[2]https://www.nejm.org/doi/full/10.1056/NEJMoa2208822?query=featured_home[3]https://clinicaltrials.gov/ct2/show/record/NCT05341609[4] Ensi Ma, Jingwen Ai , Yi Zhang, Jianming Zheng, Xiaogang Gao, Junming Xu, Hao Yin, Zhiren Fu, Hao Xing, Li Li, Liying Sun, Heyu Huang, Quanbao Zhang, Linlin Xu, Yanting Jin, Rui Chen, Guoyue Lv, Zhijun Zhu, Wenhong Džans, Džensjins Vans.(2022) Omicron infekciju profils un vakcinācijas statuss 1881 aknu transplantācijas saņēmēja vidū: daudzcentru retrospektīva kohorta.Emerging Microbes & Infections 11:1, 2636.–2644. lpp.
Izlikšanas laiks: Jan-06-2023
 中文网站
中文网站